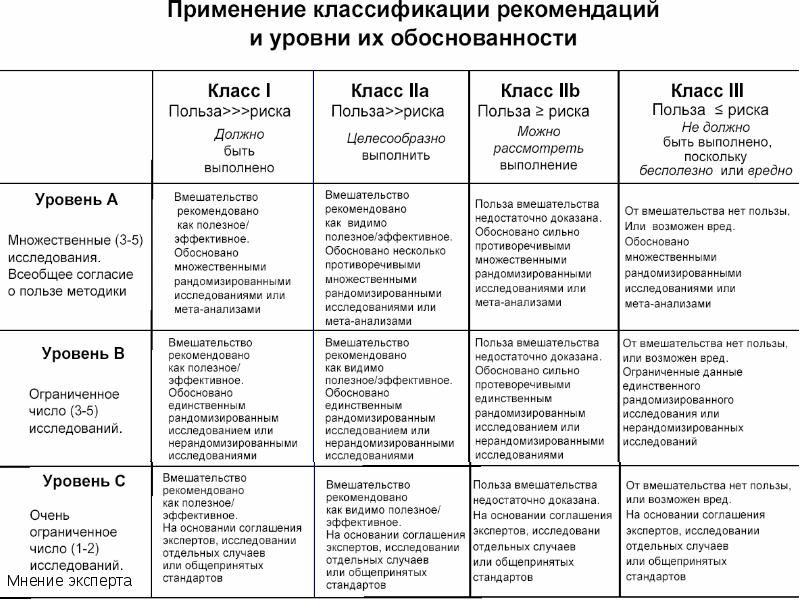
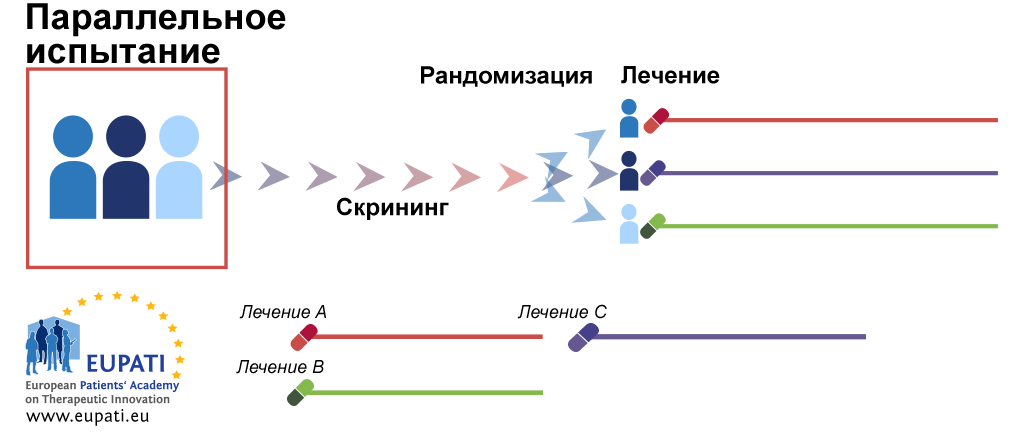
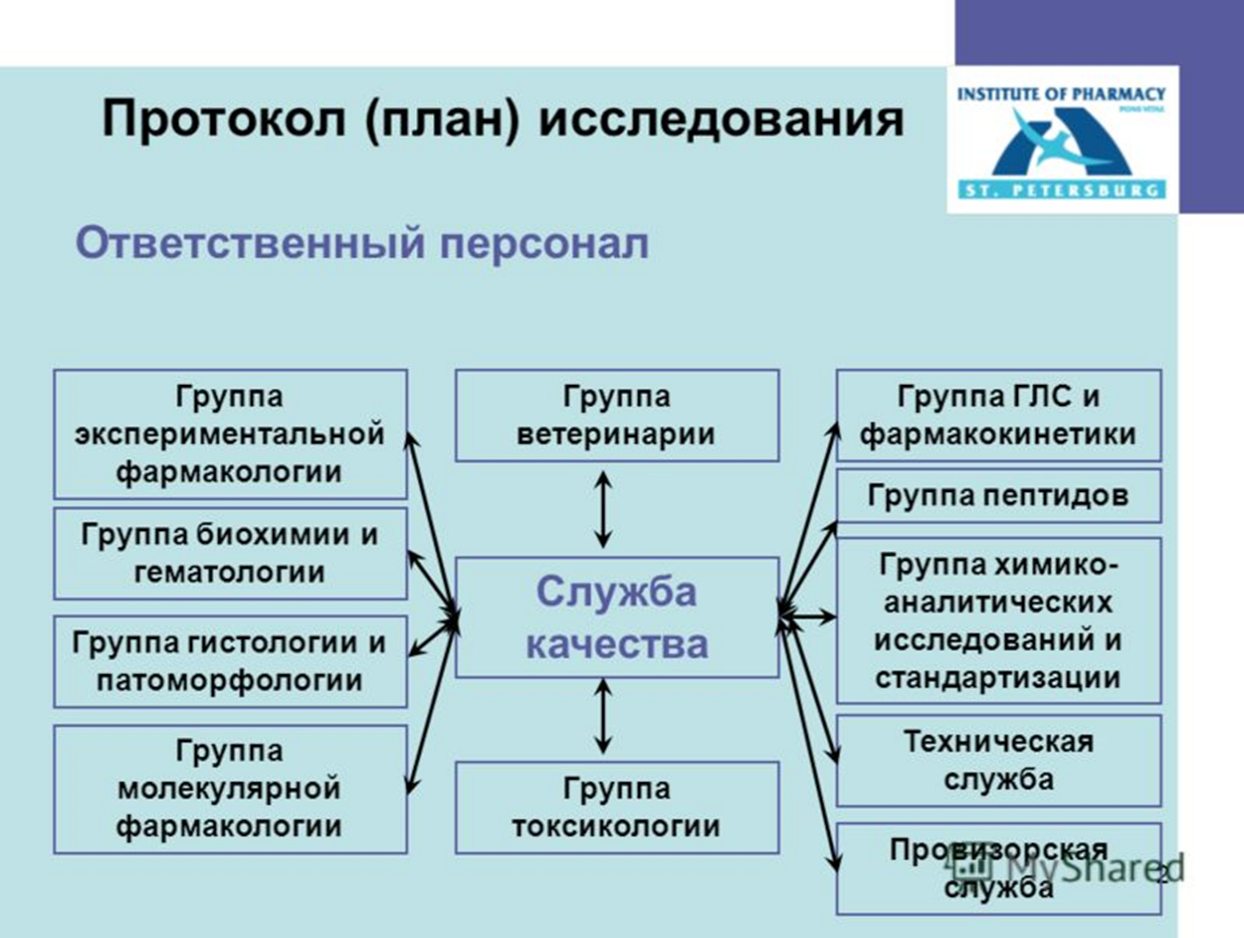
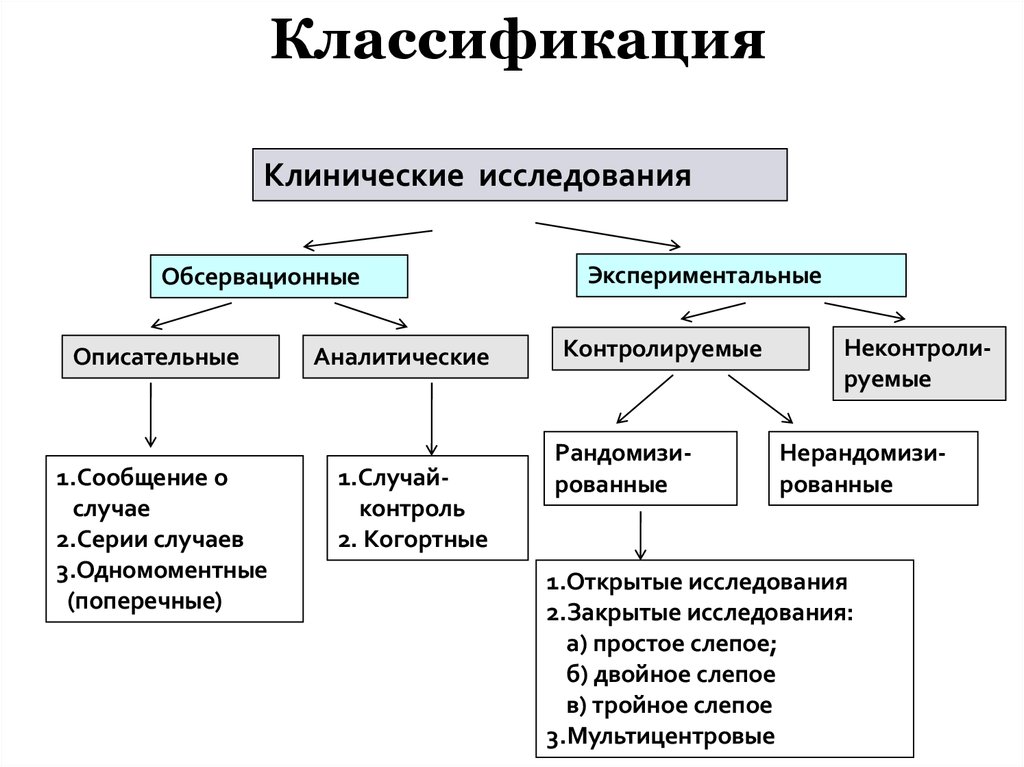
Дизайне исследования - Виды клинических исследований лекарственных средств

Вы точно человек?
Общая информация 2. Клинические испытания медицинских изделий 3. Апробация медицинских изделий 4. Клинические исследования лекарственных средств 5.








Информационно-правовая система нормативных правовых актов Республики Казахстан. Коллегия Евразийской экономической комиссии в соответствии со статьей 30 Договора о Евразийском экономическом союзе от 29 мая года и пунктом 3 статьи 3 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря года,. Председатель Коллегии Евразийской экономической комиссии Т. Принципы клинических исследований, установленные в настоящем Руководстве, также применимы к другим клиническим исследованиям например, в области радиотерапии, психотерапии, хирургии, клинических исследований медицинских изделий и альтернативных методов лечения. Принципы и подходы к проведению клинических исследований, затрагивающих безопасность субъектов клинических исследований, отражены в Правилах надлежащей клинической практики Евразийского экономического союза, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября г. Понятия, применяемые в настоящем Руководстве, используются в значениях, определенных Правилами надлежащей клинической практики.
- Содержание
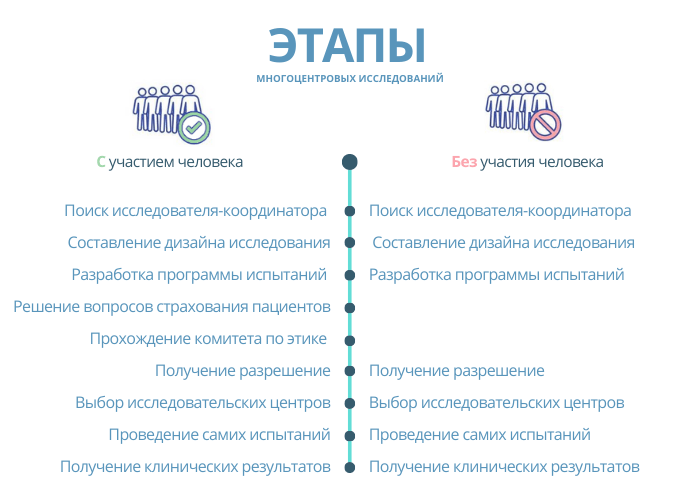
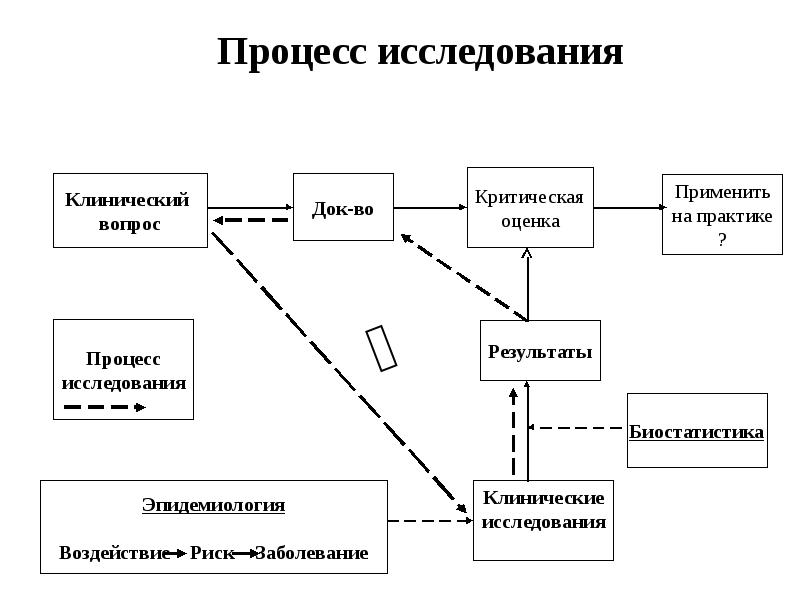
- Клиническое исследование — научное исследование, которые необходимо провести в процессе разработки лекарственного препарата перед его выводом в продажу. Исследование состоит из 4 основных этапов, описанных в соответствующем документе.
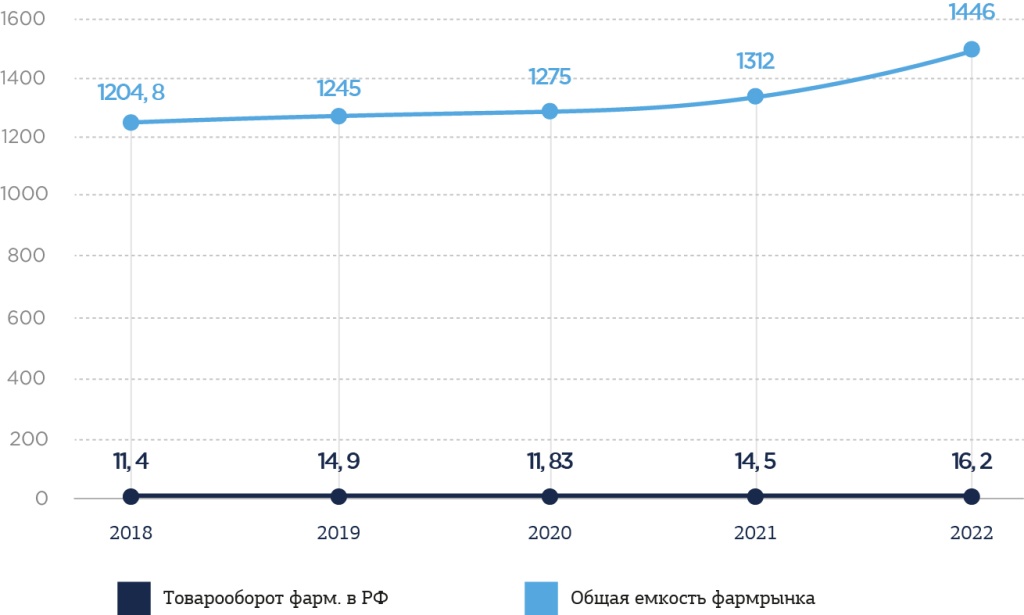
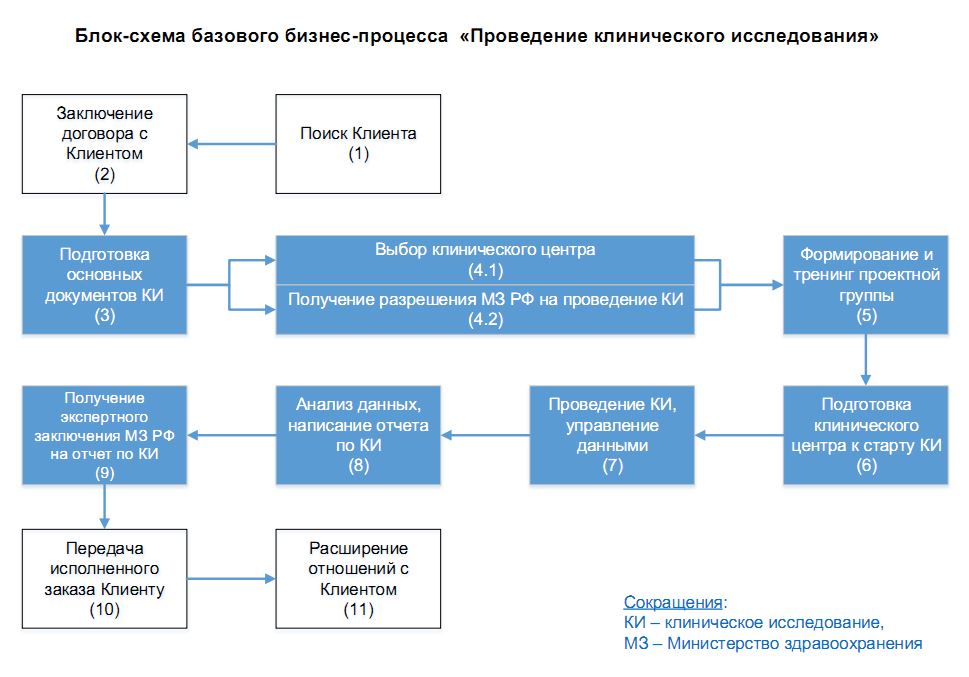
- Исследования и разработки в области лекарственных средств.
- Информационно-правовая система нормативных правовых актов Республики Казахстан. Заголовок — в редакции приказа Министра здравоохранения РК от

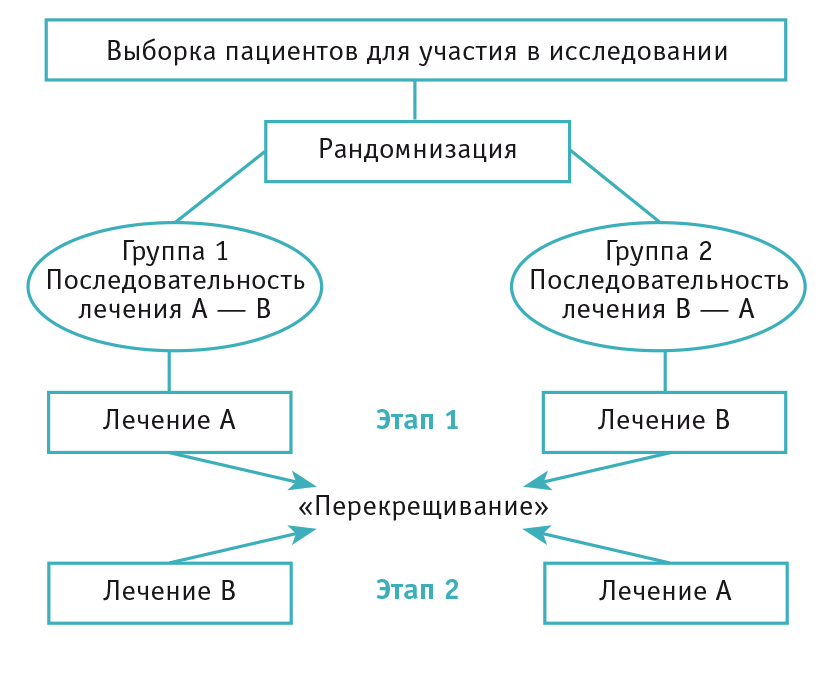





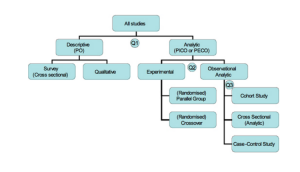


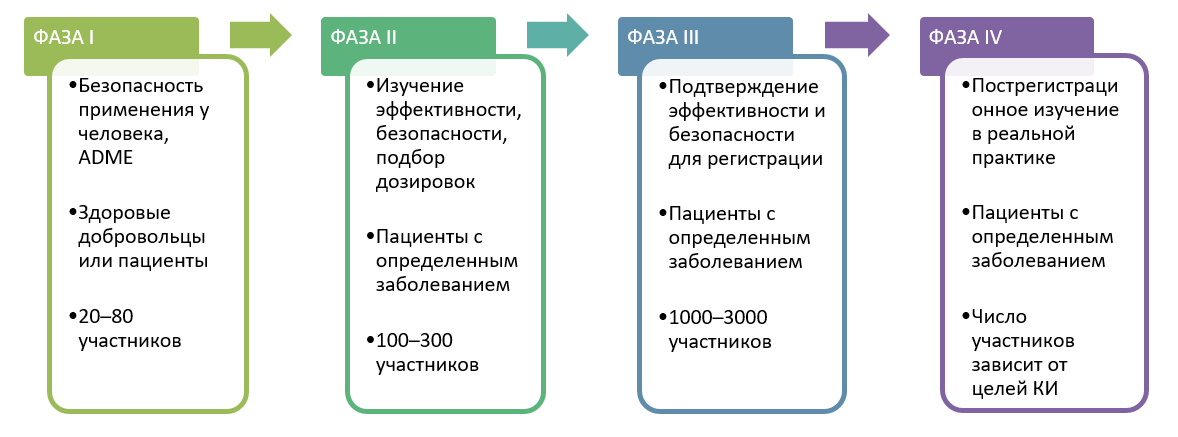
Исследования и разработки в области лекарственных средств. Согласно традиционной концепции дизайна клинического испытания каждое новое лечение должно пройти процесс разработки с жесткими требованиями. После успешных испытаний фазы I необходимо провести испытание фазы II, чтобы продемонстрировать эффективность и безопасность. После подтверждения эффективности и безопасности лекарственный препарат изучается в испытаниях фазы III, в которых он сравнивается со стандартным лечением контролем. Если так делать для каждого вида лечения отдельно, это займет много времени и потребует большого количества пациентов и существенных капиталовложений. Кроме того, в рамках этой традиционной концепции не разрешается вносить изменения в ходе испытания.